TEORIAS E FILOSOFIAS DE GRACELI 127
- Gerar link
- X
- Outros aplicativos
termodinâmica e entropia no sistema decadimensional e categorial Graceli
terça-feira, 25 de dezembro de 2018

x
decadimensional
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
 .
.x
decadimensional
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D

x
decadimensional
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D

x
decadimensional
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D

x
decadimensional
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D

x
decadimensional
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
A entropia (do grego εντροπία, entropía), unidade [J/K] (joules por kelvin), é uma grandezatermodinâmica que mensura o grau de irreversibilidade de um sistema, encontrando-se geralmente associada ao que se denomina por "desordem" (não em senso comum)[Nota 1]de um sistema termodinâmico. Em acordo com a segunda lei da termodinâmica, trabalho pode ser completamente convertido em calor, e por tal em energia térmica, mas energia térmica não pode ser completamente convertida em trabalho. Com a entropia procura-se mensurar a parcela de energia que não pode mais ser transformada em trabalho em transformações termodinâmicas à dada temperatura.
A parcela de energia interna de um sistema em seu equilíbrio termodinâmico que não pode mais ser convertida em trabalho à temperatura de equilíbrio pode ser determinada pelo produto da entropia S pela temperatura absoluta T do sistema no respectivo estado, encontrando-se disponível à execução de trabalho por tal apenas a parcela  da energia interna U em consideração. A parcela de energia interna F que pode ser convertida em trabalho, assim como a entropia, é uma função de estado do sistema, e por tal dá origem a um potencial termodinâmico: a energia livre de Helmholtz do sistema em consideração.
da energia interna U em consideração. A parcela de energia interna F que pode ser convertida em trabalho, assim como a entropia, é uma função de estado do sistema, e por tal dá origem a um potencial termodinâmico: a energia livre de Helmholtz do sistema em consideração.
 da energia interna U em consideração. A parcela de energia interna F que pode ser convertida em trabalho, assim como a entropia, é uma função de estado do sistema, e por tal dá origem a um potencial termodinâmico: a energia livre de Helmholtz do sistema em consideração.
da energia interna U em consideração. A parcela de energia interna F que pode ser convertida em trabalho, assim como a entropia, é uma função de estado do sistema, e por tal dá origem a um potencial termodinâmico: a energia livre de Helmholtz do sistema em consideração.A entropia não é uma grandeza que busca mensurar a energia ou a matéria totais encerradas pelas fronteiras do sistema termodinâmico, mas sim como esta matéria e esta energia encontram-se armazenadas e distribuídas no sistema definido por tais fronteiras. Assim, embora uma grandeza bem distinta das grandezas massa, energia interna e quantidade de matéria, a entropia de um sistema encontra-se certamente relacionada às grandezas citadas, sendo, da mesma forma que as anteriores, uma propriedade do sistema. A fim de definir-se um sistema simples especificam-se a energia interna U, a massa m - especificamente a quantidade de matéria N e a natureza das partículas que integram o sistema - e o seu volume V, e ao fazê-lo determina-se também, de forma automática, o valor da entropia S do sistema - uma grandeza escalar - no estado final a ser atingido uma vez dado tempo suficiente para que todos os processos necessários aconteçam. Assim a entropia S nos estados de equilíbrio termodinâmico é uma função das grandezas antes citadas:  .
.
 .
.Ver-se-á que os processos que levam o sistema do estado inicial logo após ter sido isolado até o estado de final - o estado de equilíbrio termodinâmico - ocorrem sempre de forma a provocarem aumentos - ou no limite a manutenção - do valor da entropia do sistema. Não ocorrem processos que impliquem a diminuição da entropia total de um sistema isolado. A entropia é, pois, uma função de estado que obedece a um princípio de maximização, o "princípio da máxima entropia": a entropia em um estado de equilíbrio termodinâmico - satisfeitas as restrições impostas ao sistema - é sempre a máxima possível.
A entropia é uma função de estado cujo valor sempre cresce durante processos naturais em sistemas isolados; e quando escrita em função das grandezas extensivas energia interna U, volume V e número de elementos N - no caso dos sistemas termodinâmicos mais simples - a entropia  é, assim como as respectivas Transformadas de Legendre, uma equação fundamental para o sistema termodinâmico em questão. É, então, possível, a partir desta e de todo o formalismo termodinâmico, obter-se qualquer informação física relevante para o sistema em estudo.[1]
é, assim como as respectivas Transformadas de Legendre, uma equação fundamental para o sistema termodinâmico em questão. É, então, possível, a partir desta e de todo o formalismo termodinâmico, obter-se qualquer informação física relevante para o sistema em estudo.[1]
 é, assim como as respectivas Transformadas de Legendre, uma equação fundamental para o sistema termodinâmico em questão. É, então, possível, a partir desta e de todo o formalismo termodinâmico, obter-se qualquer informação física relevante para o sistema em estudo.[1]
é, assim como as respectivas Transformadas de Legendre, uma equação fundamental para o sistema termodinâmico em questão. É, então, possível, a partir desta e de todo o formalismo termodinâmico, obter-se qualquer informação física relevante para o sistema em estudo.[1]Se expressa em função de uma ou mais grandezas que não as citadas - cônjugas a si - a expressão para a entropia S reduz-se a uma mera equação de estado. As equações de estado, embora relacionem valores de grandezas termodinâmicas nos estados de equilíbrio, não retêm em si, individualmente, todas as informações acerca do sistema. É necessário o conhecimento de todas as equações de estado para recuperar-se a completeza acerca das informações - para a partir delas se estabelecer uma equação fundamental - e via transformada de Legendre, se estabelecer qualquer das demais equações fundamentais - se desejada.
Índice
Conceitos científicos de "desordem"[editar | editar código-fonte]
A associação incorreta da entropia com a "desordem" ao considerar-se o sentido em senso comum desta palavra leva muitas vezes a uma compreensão errônea da definição de entropia e também a usos completamente inadequados da segunda lei da termodinâmica,[Nota 2]e assim, vale estabelecer-se aqui pelo menos um conceito aceitável para o termo "desordem" que seja adequado ao meio científico.
Segundo a física estatística a desordem de um sistema pode ser associada - não diretamente mas mediante uma função logaritmo - ao número de microestados acessíveis ao sistema uma vez satisfeitas as restrições impostas a ele. Restrições práticas comuns em sistemas termodinâmicos ligam-se geralmente ao valor da energia interna U e ao volume V disponíveis ao sistema, e aumentar a desordem de um sistema significa aumentar o número de microestados (de configurações) acessíveis às partículas deste sistema.
Um exemplo elucidador mas não exatamente análogo seria o que se obtém quando considera-se um baralho. Imposta a restrição de que todas as suas 54 cartas estejam em uma dada ordem pré-estabelecida, há apenas uma possibilidade de sequência para as cartas, ou seja, há apenas um microestado acessível a este sistema. Sua entropia seria, portanto, zero (pois ln 1 = 0). O número de microestados sobe para 54 se permitir-se que apenas uma dada carta esteja fora da ordem, e é significativamente maior se considerada a restrição de que apenas a primeira carta na sequência seja um ás. Se a restrição for relaxada ainda mais, impondo-se apenas que as cartas sejam as cartas de um único baralho completo (restrição antes também subentendida) o sistema terá o maior número de configurações possíveis, a maior desordem possível, e portanto a maior entropia possível. Aumentar a desordem, ou seja, a entropia de um sistema termodinâmico significa, de forma similar, dar-lhe condições para que haja um maior número de microestados acessíveis às partículas que o compõem.
A comparação com o baralho não é direta pois em sistemas termodinâmicos há de se considerar a indistinguibilidade das partículas (o que não ocorre com as cartas) e o que vem a ser um microestado, ou seja, uma configuração do sistema, entre outros pormenores, mas de forma geral, assim como ocorre para o baralho, a remoção de restrições impostas ao sistema em equilíbrio leva a um aumento na sua entropia. Importante também é observar que um aumento da energia interna U mantidas as restrições espaciais leva a um aumento de microestados acessíveis às partículas do sistema pois estas têm, agora, mais energia, e portanto a um aumento na entropia deste. A entropia cresce com a energia interna U de forma monótona para sistemas estáveis, o que significa dizer, em acordo com a definição de temperatura [Nota 3]absoluta, que, para sistemas em equilíbrio, a temperatura absoluta nunca pode ser negativa.
Há em verdade várias interpretações cientificamente corretas para o termo "desordem", e citar-se-á também uma oriunda da termodinâmica e diretamente associada à segunda lei da termodinâmica e ao estudo da máquina térmica e das transformações de energia (calor e trabalho) nestas máquinas. A segunda lei obriga que uma máquina térmica (ou um refrigerador) tenha necessariamente uma fonte quente e uma fonte fria. Um aumento da entropia representa, em tais sistemas, uma medida da energia que, oriunda da fonte quente, poderia ter sido aproveitada na forma de trabalho, mas, não o sendo, foi simplesmente "desperdiçada" como calor na fonte fria, tornado-se doravante indisponível para produzir o citado trabalho. A associação com desordem provém da observação de que trabalho em física envolve necessariamente variação de volume de uma parte do sistema, ou seja, o movimento direcionado de uma fronteira restritiva interna ao sistema isolado (a fronteira comum entre dois de seus subsistemas), e por conseguinte movimento direcionado, ordenado, de todas as partículas do subsistema delimitado por esta fronteira em movimento. Trabalho tem assim a ver com transferência de energia cinética (energia térmica), mas as partículas responsáveis por esta transferência movem-se de forma ordenada, direcionada, "acompanhando" a fronteira em movimento. Já a energia térmica trocada na forma de calor implica também variação da energia de movimento das partículas dos subsistemas, mas estas partículas agora movem-se de forma completamente desordenadas durante esta troca. O calor, oposto ao trabalho, implica a "propagação" de energia térmica mediante movimentos aleatórios - transferência de energia térmica (cinética) em forma não espacialmente direcionada -, feito de forma que a fronteira do sistema efetivamente não se move (o calor "passa" pela fronteira). Assim, o aumento de entropia, e portanto da desordem, de um sistema significa transformar parte do "movimento ordenado" das partículas de um sistema - que poderia ser usado para fazer trabalho - em movimento "desordenado", não associado a trabalho. O calor é a forma mais evidente de se fazer a entropia do sistema variar, ao passo que a troca de energia mediante trabalho por si só não implica variação da entropia, conforme visto.
Aumentar a desordem significa, assim, desperdiçar energia que poderia em princípio ser aproveitada como trabalho e, não o sendo, foi simplesmente entregue na forma de calor à fonte fria do sistema. Uma vez entregue à fonte fria, a energia atrelada ao aumento de entropia não pode mais, em contexto global, ser convertida em trabalho.
Transformações[editar | editar código-fonte]
Transformações reversíveis[editar | editar código-fonte]

A entropia é um conceito essencial ao estudo das máquinas térmicas.
A ideia de entropia, uma grandeza física que encontra sua definição dentro da área da termodinâmica,[Nota 4]surgiu no seguimento de uma função criada por Clausius[2] a partir de um processo cíclico reversível. Sendo Q o calor trocado entre o sistema e sua vizinhança, e T a temperatura absoluta do sistema, em todo processo reversível a integral de curva de  só depende dos estados inicial e final, sendo independente do caminho seguido. Portanto deve existir uma função de estado do sistema, S = f (P, V, T), chamada de entropia, cuja variação em um processo reversível entre os estados inicial e final é:[Nota 5]
só depende dos estados inicial e final, sendo independente do caminho seguido. Portanto deve existir uma função de estado do sistema, S = f (P, V, T), chamada de entropia, cuja variação em um processo reversível entre os estados inicial e final é:[Nota 5]
 só depende dos estados inicial e final, sendo independente do caminho seguido. Portanto deve existir uma função de estado do sistema, S = f (P, V, T), chamada de entropia, cuja variação em um processo reversível entre os estados inicial e final é:[Nota 5]
só depende dos estados inicial e final, sendo independente do caminho seguido. Portanto deve existir uma função de estado do sistema, S = f (P, V, T), chamada de entropia, cuja variação em um processo reversível entre os estados inicial e final é:[Nota 5], sendo Q reversível
A entropia física, em sua forma clássica é dada por:
, desde que o calor seja trocado de forma reversível
ou, quando o processo é isotérmico:
O significado desta equação pode ser descrito, em linguagem corrente, da seguinte forma:
- Em processos reversíveis como o descrito, quando um sistema termodinâmico passa do estado 1 ao estado 2, a variação em sua entropia é igual à variação da quantidade de calor trocada (de forma reversível) dividido pela temperatura.
Processos de não equilíbrio[editar | editar código-fonte]
Em processos mais complexos, o que inclui os processos irreversíveis e de não equilíbrio como a expansão livre, entropia pode e sempre é produzida dentro do próprio sistema, e a variação total na entropia destes sistemas é igual à soma de dois termos: a entropia produzida e a entropia trocada com a vizinhança. A entropia trocada equivale, em processos quase estáticos, conforme descrito, à integral de dQ/T, sendo sempre nula quando a transformação é adiabática. O uso desta expressão ao casos de processos de não equilíbrio é contudo inadequado, ou, no mínimo, requer muita cautela, visto que a própria definição de temperatura fica comprometida. Já a entropia produzida vale zero apenas quando o processo é reversível, sendo sempre positiva em transformações irreversíveis.
Observa-se que em todas os processos a entropia total do sistema mais vizinhança ou aumenta (processos irreversíveis), ou fica constante (transformações reversíveis). Na prática, apesar de existirem processos que muito se aproximam dos reversíveis, toda transformação leva a um aumento na entropia total do sistema mais vizinhança, e este princípio permite definir a Segunda Lei da Termodinâmica, cuja implicação direta consiste no fato de que um processo tende a dar-se de forma espontânea em único sentido, aquele que leve ao aumento da entropia total (do sistema mais vizinhança). Por esses motivos, a entropia também é chamada de flecha do tempo.
Como não é possível determinar-se o aumento da entropia partindo-se diretamente de considerações sobre os sistemas que estão em processos de não equilíbrio - irreversíveis - justamente por estes estarem fora do equilíbrio, para determinar-se a variação de entropia total sofrida por um sistema ao longo de um processo de não equilíbrio determina-se a diferença entre as entropias inicial e final associadas aos respectivos estados de equilíbrio inicial e final. Tal consideração leva em conta o fato de a entropia ser uma função de estado, e por tal sua variação não depende de como o sistema saiu de um estado e chegou ao outro, e sim apenas dos estados inicial e final envolvidos.
A unidade de entropia no SI é designada por J/K'.
Definição termodinâmica[editar | editar código-fonte]
No início da década de 1850, Rudolf Clausius descreveu o conceito de energia desperdiçada em termos de diferenciais.
Em 1876, o físico, químico e matemático Willard Gibbs chegou à conclusão de que o conceito de energia disponível ΔG em um sistema termodinâmico é matematicamente obtido através da subtração entre a energia perdida TΔS e a variação da energia total do sistema ΔH.
- - "Existe uma função (denominada entropia S) dos parâmetros extensivos de um sistema definida para todos os estados de equilíbrio termodinâmico deste sistema e com a seguinte propriedade: dentre todos os estados de equilíbrio possíveis que satisfazem as restrições físicas impostas ao sistema o estado de equilíbrio assumido pelo sistema será aquele para o qual os valores dos parâmetros extensivos neste estado levem à maximização do valor de sua entropia S. Em um sistema sem restrições internas a entropia é a maior possível."
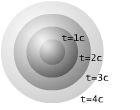
A exemplo, na parte superior da figura ao lado tem-se um sistema com uma fronteira adiabática e uma restrição interna. O estado de equilíbrio termodinâmico de um sistema, satisfeitas as restrições internas, corresponde ao estado onde a entropia é a máxima possível. Na parte inferior a restrição é removida. O sistema passa por transformações e, após certo tempo atinge um novo estado de equilíbrio termodinâmico. Nestas transformações a entropia do sistema geralmente aumenta, o que ocorre para expansão livre mostrada, ou em casos outrem específicos - quando todos os processos se fazem de forma reversível - não se altera. A entropia de um sistema isolado nunca diminui.
Assim, o estado de equilíbrio realmente assumido por um sistema termodinâmico é, satisfeitas as restrições físicas impostas, o estado de maior entropia possível, e a remoção de uma restrição leva geralmente a um aumento da entropia do sistema composto, ou, em caso específicos (transformações reversíveis), à manutenção de seu valor, mas nunca a uma diminuição da mesma.
Há três outros postulados que, em termodinâmica, mostram-se diretamente associados à definição de entropia, sendo eles:
- - "A entropia de um sistema composto é aditiva sobre os subsistemas que o constituem. A entropia é contínua e diferenciável e é uma função monótona crescente da energia internaU."
- - "A entropia de um sistema é nula para um estado onde a temperatura absoluta T também o seja."
- - "Existe um estado particular - chamado estado de equilíbrio - de um sistema que, macroscopicamente, é completamente caracterizado pela energia interna U, pelo volume V, e pela quantidade de matéria N1, N2,N3 de seus constituintes químicos.".[Nota 7]
A entropia S quando expressa em função do volume V do sistema, da quantidade de partículas N do sistema e da energia interna U do sistema, S(U,N,V), é uma Equação Termodinâmica Fundamental para um sistema termodinâmico simples, e pode, mediante a Transformada de Legendre, ser transformada em outras equações fundamentais como a equação da Entalpia H(S,P,N), Energia de Helmholtz F(T,V,N), Energia livre de Gibbs G(T,P,N) ou o Grande Potencial Canônico U(T,P,m). Em sistemas termodinâmicos mais complexos, a exemplo em sistemas magnéticos, outras variáveis podem vir a figurar na equação entrópica fundamental e nas outras equações fundamentais, entretanto os conceitos de equação fundamental e transformada de Legendre permanecem os mesmos.
As equações fundamentais diferem das equações de estado basicamente no fato de que a partir de uma equação fundamental pode-se obter, com o uso do formalismo termodinâmico, qualquer informação a respeito do sistema termodinâmico por ela descrito, inclusive as equações de estado para este sistema, ao passo que o mesmo não pode ser feito a partir de uma equação de estado, que não retém em si todas as informações necessárias a respeito do sistema. É necessário um conjunto de equações de estado para a descrição completa de um sistema termodinâmico (do qual poderia obter-se, então, as equações fundamentais).
Primeira Lei da Termodinâmica[editar | editar código-fonte]
A primeira lei da termodinâmica é a lei de conservação de energia aplicada aos processos térmicos. Nela observamos a equivalência entre trabalho e calor. Este princípio pode ser enunciado a partir do conceito de energia interna. Esta pode ser entendida como a energia associada aos átomos e moléculas em seus movimentos e interações internas ao sistema. Num sistema isolado a energia total permanece constante.[Nota 8]
Segunda Lei da Termodinâmica[editar | editar código-fonte]
A Segunda Lei da Termodinâmica, uma importante lei física, determina que a entropia total de um sistema termodinâmico isolado tende a aumentar com o tempo, aproximando-se de um valor máximo à medida que restrições internas ao sistema são removidas. O estado de equilíbrio termodinâmico de um sistema isolado corresponde ao estado onde, satisfeitas as restrições internas, a entropia é máxima. Duas importantes consequências disso são que o calor não pode passar naturalmente de um corpo frio a um corpo quente, e que um Moto perpétuo, ou seja, um motor que produza trabalho infinitamente, mas por calor, seja impossível.[Nota 9]
Interpretação estatística[editar | editar código-fonte]
Em 1877, Ludwig Boltzmann visualizou um método probabilístico para medir a entropia de um determinado número de partículas de um gás ideal, na qual ele definiu entropia como proporcional ao logaritmo neperiano do número de microestados que um gás pode ocupar:
Onde S é a entropia, k é a constante de Boltzmann e Ω é o número de microestados possíveis para o sistema.
O trabalho de Boltzmann consistiu em encontrar uma forma de obter a equação entrópica fundamental S a partir de um tratamento matemático-probabilístico [Nota 10]facilmente aplicável aos sistemas em questão. Ao fazê-lo, conectou o todo poderoso formalismo termodinâmico associado à equação fundamental a um método de tratamento probabilístico simples que exige apenas considerações físicas primárias sobre o sistema em análise, obtendo, a partir de considerações básicas, todo o comportamento termodinâmico do sistema. A equação de Boltzman mostra-se muito importante para o estudo termodinâmico de tais sistemas, e reconhecida como tal pelo próprio autor, encontra-se gravada em sua lápide.[Nota 11]
Força associada à entropia[editar | editar código-fonte]
Qual é a origem da força entrópica? A resposta mais geral é que um sistema sempre quer retornar ao seu estado de máxima entropia, isso explica porque as moléculas tendem a resistir sair do seu estado de desordem.
Em física, uma força entrópica atuando em um sistema é uma força resultante da tendência termodinâmica de todo o sistema para aumentar sua entropia. A abordagem entrópica para o movimento browniano foi inicialmente proposta por RM Neumann,[3] Neumann associou a força entrópica de uma partícula em movimento browniano tridimensional usando a equação de Boltzmann e denotou esta força como uma força motriz.
Formulação matemática[editar | editar código-fonte]
A dedução dessa fórmula parte da primeira lei da termodinâmica e da definição de trabalho, considerando dilatações pequenas podemos escrever a primeira lei na forma:

No entanto, se a dilatação total objeto (dE) for pequena e a considerarmos igual à zero, obtemos a expressão para a força exercida pelo elástico:

Polímeros[editar | editar código-fonte]
Podemos sentir o efeito da entropia ao esticarmos um elástico, por exemplo. A borracha é formada por longas cadeias de polímeros com ligações cruzadas – que lembram ziguezagues. Quando o elástico está relaxado essas cadeias estão parcialmente enroladas e ordenadas aleatoriamente, devido a esse alto grau de desordem das moléculas o estado possui um valor de entropia também alto. Ao esticarmos o elástico desenrolamos essas moléculas e as alinhamos, como o alinhamento diminui a desordem isso significa dizer que a derivada  se torna negativa e consequentemente a força exercida pelos polímeros se torna positiva. Essa força se deve a tendência das moléculas de voltar ao estado menos ordenado (com uma maior entropia).
se torna negativa e consequentemente a força exercida pelos polímeros se torna positiva. Essa força se deve a tendência das moléculas de voltar ao estado menos ordenado (com uma maior entropia).
 se torna negativa e consequentemente a força exercida pelos polímeros se torna positiva. Essa força se deve a tendência das moléculas de voltar ao estado menos ordenado (com uma maior entropia).
se torna negativa e consequentemente a força exercida pelos polímeros se torna positiva. Essa força se deve a tendência das moléculas de voltar ao estado menos ordenado (com uma maior entropia).Força hidrofóbica[editar | editar código-fonte]
Outro exemplo de força entrópica são as interações hidrofóbicas. Elas ocorrem em função do aumento da entropia (∆S) do sistema proveniente da liberação das moléculas de água, quando dois átomos apolares interagem. As interações hidrofóbicas possuem papel importante na estabilização de complexos entre ligantes e receptores, como acontece nas proteínas (macromoléculas formada pela união de uma sequência de aminoácidos), onde as cadeias hidrofílicas ficam no exterior e as cadeias hidrofóbicas ficam no interior da proteína, dando conformação a macromolécula, como um envelopamento da molécula.
Gravidade[editar | editar código-fonte]
A gravidade tem sido considerada pela física moderna uma força entrópica. Erik Verlinde alegou que a gravidade é uma consequência da "informação associada com as posições dos corpos materiais". Isso implica que a gravidade não é uma força fundamental , mas um fenômeno emergente.
Superfícies isentrópicas[editar | editar código-fonte]
Superfícies isentrópicas são superfícies formadas por todos os pontos que apresentem, em um diagrama de estados — onde os eixos coordenados estão associados às grandezas termodinâmicas como pressão, volume e temperatura (etc.), e cada ponto representa um possível estado de equilíbrio termodinâmico do sistema —, o mesmo valor para a entropia S.
Transformações sofridas pelo sistema são expressas como linhas unindo uma sequência de pontos no diagrama de estados, ou como "saltos" entre estes pontos.
Para um sistema isolado que sofra apenas transformações reversíveis, as linhas que representam as mudanças de estado estão restritas à superfície isentrópica à qual pertence o estado inicial. O sistema pode ser levado de um estado inicial a qualquer outro estado representado por ponto sobre a mesma isentópica sem comprometer a possibilidade de retorno ao estado inicial, feita também sobre a mesma superfície isentrópica.
Transformações irreversíveis em sistemas isolados (como a expansão livre) conectam pontos em isentrópicas distintas. Uma vez descrito por ponto em outra isentrópica (de valor S maior), o sistema isolado jamais poderá retornar ao estado inicial, ficando todos os estados associados à isentrópica anterior inacessíveis ao sistema isolado, que agora pode assumir apenas configurações descritas por pontos na sua nova isentrópica, ou em isentrópicas superiores (com maiores valores de S).
O retorno do sistema a isentrópicas com menores valores de S só é possível mediante a troca de calor e de entropia com a vizinhança, e assim, neste caso, o sistema não poderá mais estar adiabaticamente isolado. Tem-se então, em acordo com a Segunda Lei da Termodinâmica, uma redução na entropia do sistema às custas de um aumento na entropia global do conjunto sistema mais vizinhança.
Escoamentos isentrópicos são uma boa aproximação para os escoamentos atmosféricos reais em escala sinótica, nas regiões sem precipitação (por exemplo, nos escoamentos anticiclônicos, anti-horários no Hemisfério Sul e horários no Hemisfério Norte) e em equilíbrio radiativo (o ganho é igual à perda da densidade de fluxo radiativo).
postulado categorial e decadimensional Graceli.
TUDO QUE ESTÁ RELACIONADO COM ENERGIA, ESTRUTURAS, FENÔMENOS E DIMENSÕES ESTÁ INSERIDO NO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.
todo sistema decadimensional e categorial é um sistema transcendente e indeterminado.
TUDO QUE ESTÁ RELACIONADO COM ENERGIA, ESTRUTURAS, FENÔMENOS E DIMENSÕES ESTÁ INSERIDO NO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.
todo sistema decadimensional e categorial é um sistema transcendente e indeterminado.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
1] Cosmic space.
2] Cosmic and quantum time.
3] Structures.
4] Energy.
5] Phenomena.
6] Potential.
7] Phase transitions of physical [amorphous and crystalline] states and states of energies and phenomena of Graceli.
8] Types and levels of magnetism [in paramagnetic, diamagnetic, ferromagnetic] and electricity, radioactivity [fissions and fusions], and light [laser, maser, incandescence, fluorescence, phosphorescence, and others.
9] thermal specificity, other energies, and structure phenomena, and phase transitions.
10] action time specificity in physical and quantum processes.
2] Cosmic and quantum time.
3] Structures.
4] Energy.
5] Phenomena.
6] Potential.
7] Phase transitions of physical [amorphous and crystalline] states and states of energies and phenomena of Graceli.
8] Types and levels of magnetism [in paramagnetic, diamagnetic, ferromagnetic] and electricity, radioactivity [fissions and fusions], and light [laser, maser, incandescence, fluorescence, phosphorescence, and others.
9] thermal specificity, other energies, and structure phenomena, and phase transitions.
10] action time specificity in physical and quantum processes.
Sistema decadimensional Graceli.
1]Espaço cósmico.
2]Tempo cósmico e quântico.
3]Estruturas.
4]Energias.
5]Fenômenos.
6]Potenciais.
7]Transições de fases de estados físicos [amorfos e cristalinos] e estados de energias e fenômenos de Graceli.
8]Tipos e níveis de magnetismo [em paramagnéticos, diamagnético, ferromagnéticos] e eletricidade, radioatividade [fissões e fusões], e luz [laser, maser, incandescências, fluorescências, fosforescências, e outros.
9] especificidade térmica, de outras energias, e fenômenos das estruturas, e transições de fases.
10] especificidade de tempo de ações em processos físicos e quântico.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Matriz categorial de Graceli.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
Tipos, níveis, potenciais, tempo de ação, temperatura, eletricidade, magnetismo, radioatividade, luminescências, dinâmicas, estruturas, fenômenos, transições de fenômenos e estados físicos, e estados de energias, dimensões fenomênicas de Graceli.
[estruturas: isótopos, partículas, amorfos e cristalinos, paramagnéticos, dia, ferromagnéticos, e estados [físicos, quântico, de energias, de fenômenos, de transições, de interações, transformações e decaimentos, emissões e absorções, eletrostático, condutividade e fluidez]].
trans-intermecânica de supercondutividade no sistema categorial de Graceli.
EPG = d [hc] [T / IEEpei [pit] = [pTEMRLD] and [fao] [itd] [iicee] tetdvd [pe] cee [caG].]
p it = potentials of interactions and transformations.
Temperature divided by isotopes and physical states and potential states of energies and isotopes = emissions, random wave fluxes, ion interactions, charges and energies structures, tunnels and entanglements, transformations and decays, vibrations and dilations, electrostatic potential, conductivities, entropies and enthalpies. categories and agents of Graceli.
h e = quantum index and speed of light.
[pTEMRlD] = THERMAL, ELECTRICAL, MAGNETIC, RADIOACTIVE, Luminescence, DYNAMIC POTENTIAL] ..
EPG = GRACELI POTENTIAL STATUS.
[pTFE] = POTENCIAL DE TRANSIÇÕES DE FASES DE ESTADOS FÍSICOS E DE ENERGIAS E FANÔMENOS [TRANSIÇÕES DE GRACELI]
, [pTEMRLD] [hc] [pI] [PF] [pIT][pTFE] [CG].
EPG = d [hc] [T / IEEpei [pit] = [pTEMRLD] and [fao] [itd] [iicee] tetdvd [pe] cee [caG].]
p it = potentials of interactions and transformations.
Temperature divided by isotopes and physical states and potential states of energies and isotopes = emissions, random wave fluxes, ion interactions, charges and energies structures, tunnels and entanglements, transformations and decays, vibrations and dilations, electrostatic potential, conductivities, entropies and enthalpies. categories and agents of Graceli.
h e = quantum index and speed of light.
[pTEMRlD] = THERMAL, ELECTRICAL, MAGNETIC, RADIOACTIVE, Luminescence, DYNAMIC POTENTIAL] ..
EPG = GRACELI POTENTIAL STATUS.
[pTFE] = POTENCIAL DE TRANSIÇÕES DE FASES DE ESTADOS FÍSICOS E DE ENERGIAS E FANÔMENOS [TRANSIÇÕES DE GRACELI]
, [pTEMRLD] [hc] [pI] [PF] [pIT][pTFE] [CG].
O Demônio de Maxwell x o anjo de Graceli no sistema decadim. e categorial Graceli
segunda-feira, 24 de dezembro de 2018
em contrapartida ao
O Demônio de Maxwell é criado o anjo de Graceli. onde se tem uma relação entre temperaturas frias para as quentes, e vice-versa, ou seja, uma troca térmica, onde o quente dá e recebe o frio. como também varia conforme a natureza das interações físicas de energias, de fenômenos e conforme as estruturas e dimensões de Graceli. ou seja, se tem com isto outro tipo de entropia e entalpia, onde com isto
|


































































![{\displaystyle {\begin{bmatrix}{\frac {\displaystyle \partial E_{x}}{\displaystyle \partial x}}&{\frac {\displaystyle \partial E_{x}}{\displaystyle \partial y}}&{\frac {\displaystyle \partial E_{x}}{\displaystyle \partial z}}\\[12pt]{\frac {\displaystyle \partial E_{y}}{\displaystyle \partial x}}&{\frac {\displaystyle \partial E_{y}}{\displaystyle \partial y}}&{\frac {\displaystyle \partial E_{y}}{\displaystyle \partial z}}\\[12pt]{\frac {\displaystyle \partial E_{z}}{\displaystyle \partial x}}&{\frac {\displaystyle \partial E_{z}}{\displaystyle \partial y}}&{\frac {\displaystyle \partial E_{z}}{\displaystyle \partial z}}\end{bmatrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e304da2a9b65da02acaf527f0c3d5237cdc704c)





























 é a densidade de carga elétrica,
é a densidade de carga elétrica,  é a densidade de carga magnética,
é a densidade de carga magnética,  é a densidade de corrente elétrica e
é a densidade de corrente elétrica e  densidade de corrente magnética. Para calcular o valor da carga magnética g, Dirac usou a Mecânica Quântica que havia sido desenvolvida a partir de 1926. Segundo essa Mecânica, a evolução de uma partícula é traduzida por uma função de onda
densidade de corrente magnética. Para calcular o valor da carga magnética g, Dirac usou a Mecânica Quântica que havia sido desenvolvida a partir de 1926. Segundo essa Mecânica, a evolução de uma partícula é traduzida por uma função de onda  afetada por um fator de fase imaginária multiplicativo que não intervém nas medidas das grandezas observáveis daquela partícula. Assim, quando esta se desloca de um lugar para o outro, a diferença nos fatores de fase entre a partícula e a chegada de um lugar para o outro, a diferença nos fatores de fase entre a partida e a chegada da partícula serão idênticas. Com esse argumento simples, Dirac obteve as equações de Maxwell-Dirac (vistas acima) como conseqüência da restrição impostas àquelas variações de fatores de fase, bem como fez a predição do valor de g por meio da relação:
afetada por um fator de fase imaginária multiplicativo que não intervém nas medidas das grandezas observáveis daquela partícula. Assim, quando esta se desloca de um lugar para o outro, a diferença nos fatores de fase entre a partícula e a chegada de um lugar para o outro, a diferença nos fatores de fase entre a partida e a chegada da partícula serão idênticas. Com esse argumento simples, Dirac obteve as equações de Maxwell-Dirac (vistas acima) como conseqüência da restrição impostas àquelas variações de fatores de fase, bem como fez a predição do valor de g por meio da relação:  (
( ) onde e é a carga do elétron e
) onde e é a carga do elétron e  = h/2
= h/2 , sendo h a constante de Planck. É oportuno salientar que o físico norte-americano John David Jackson (n.1925) em seu famoso livro Classical Electrodynamics (John Wiley & Sons, 1992) apresenta um argumento semiclássico para encontrar a condição de quantização Diraciana indicada acima, considerando o movimento de um elétron em um campo de um monopolo magnético constante.
, sendo h a constante de Planck. É oportuno salientar que o físico norte-americano John David Jackson (n.1925) em seu famoso livro Classical Electrodynamics (John Wiley & Sons, 1992) apresenta um argumento semiclássico para encontrar a condição de quantização Diraciana indicada acima, considerando o movimento de um elétron em um campo de um monopolo magnético constante. são fechadas, fato esse traduzido pela expressão integral:
são fechadas, fato esse traduzido pela expressão integral:  (ou, equivalentemente,
(ou, equivalentemente,  ). Para contornar essa dificuldade, ainda no artigo de 1931, Dirac propôs que o monopolo magnético encontra-se no fim de uma "linha" - linha de Dirac – formada de dipolos magnéticos (ou, equivalentemente, de um solenóide delgado de espiras bem próximas), que se estende até o infinito e que, no entanto, ainda segundo Dirac, um elétron não a poderia cruzar. Tal “linha”, cuja orientação a priori não pode ser definida, não tem efeito detectável. Registre-se que, em 1948 (Physical Review 74, p. 817), Dirac tratou da não-observabilidade de suas “linhas”.
). Para contornar essa dificuldade, ainda no artigo de 1931, Dirac propôs que o monopolo magnético encontra-se no fim de uma "linha" - linha de Dirac – formada de dipolos magnéticos (ou, equivalentemente, de um solenóide delgado de espiras bem próximas), que se estende até o infinito e que, no entanto, ainda segundo Dirac, um elétron não a poderia cruzar. Tal “linha”, cuja orientação a priori não pode ser definida, não tem efeito detectável. Registre-se que, em 1948 (Physical Review 74, p. 817), Dirac tratou da não-observabilidade de suas “linhas”.  ) e magnético (
) e magnético ( ) ou vetor (
) ou vetor ( ) que descrevem os meios eletromagnéticos, mas sim um fator de fase como sendo responsável pelos fenômenos eletromagnéticos e de maneira unívoca. Assim, ao escolherem um sistema de coordenadas conveniente, comprovaram que a linha de Dirac nada mais é do que a “projeção” de um monopolo magnético do mesmo modo que, em Cartografia, o planisfério tem os pólos terrestres representados por linhas e não por pontos. Nessa situação, muito embora as “calotas esféricas” que envolvem o monopolo magnético tenham os potenciais eletromagnéticos com valores diferentes, existe, no entanto, uma função que transforma esses potenciais, passando de um para o outro sem mudar o fator de fase.
) que descrevem os meios eletromagnéticos, mas sim um fator de fase como sendo responsável pelos fenômenos eletromagnéticos e de maneira unívoca. Assim, ao escolherem um sistema de coordenadas conveniente, comprovaram que a linha de Dirac nada mais é do que a “projeção” de um monopolo magnético do mesmo modo que, em Cartografia, o planisfério tem os pólos terrestres representados por linhas e não por pontos. Nessa situação, muito embora as “calotas esféricas” que envolvem o monopolo magnético tenham os potenciais eletromagnéticos com valores diferentes, existe, no entanto, uma função que transforma esses potenciais, passando de um para o outro sem mudar o fator de fase.  (
( ) a sua detecção envolve altas energias que só são conseguidas em experiências com os raios cósmicos remanescentes da formação de nosso Universo, por ocasião do Big-Bang. É oportuno destacar que a estimativa dessa alta massa do monopolo magnético foi apresentada, em trabalhos independentes realizados em 1974, pelos físicos, o holandês Gerardus ´t Hooft (n.1946; PNF, 1999) (Nuclear Physics B79, p. 276) e o russo Alexander Polyakov (Journal of Experimental and Theoretical Physics: Letters 20, p. 194), ao estudarem a unificação entre as forças eletromagnética, fraca e forte, a hoje conhecida Teoria da Grande Unificação (TGU), formulada em 1974. Destaque-se também que, nessa Teoria, o próton (p) é uma partícula instável, com uma vida média da ordem de 1031 anos (lembrar que a idade do Universo, até o presente momento, é considerada ser da ordem de 1010 anos), podendo decair, segundo artigos independentes publicados em 1982, por Vladimir Rubakov (Nuclear Physics B203, p. 311) e Curtis G. Callan (Physical Review D25, p. 2141), em um monopolo magnético (M), pósitron (e+) e neutrino do pósitron (
) a sua detecção envolve altas energias que só são conseguidas em experiências com os raios cósmicos remanescentes da formação de nosso Universo, por ocasião do Big-Bang. É oportuno destacar que a estimativa dessa alta massa do monopolo magnético foi apresentada, em trabalhos independentes realizados em 1974, pelos físicos, o holandês Gerardus ´t Hooft (n.1946; PNF, 1999) (Nuclear Physics B79, p. 276) e o russo Alexander Polyakov (Journal of Experimental and Theoretical Physics: Letters 20, p. 194), ao estudarem a unificação entre as forças eletromagnética, fraca e forte, a hoje conhecida Teoria da Grande Unificação (TGU), formulada em 1974. Destaque-se também que, nessa Teoria, o próton (p) é uma partícula instável, com uma vida média da ordem de 1031 anos (lembrar que a idade do Universo, até o presente momento, é considerada ser da ordem de 1010 anos), podendo decair, segundo artigos independentes publicados em 1982, por Vladimir Rubakov (Nuclear Physics B203, p. 311) e Curtis G. Callan (Physical Review D25, p. 2141), em um monopolo magnético (M), pósitron (e+) e neutrino do pósitron ( ), isto é:
), isto é:  .
. 



 + [F,D, P]
+ [F,D, P]

